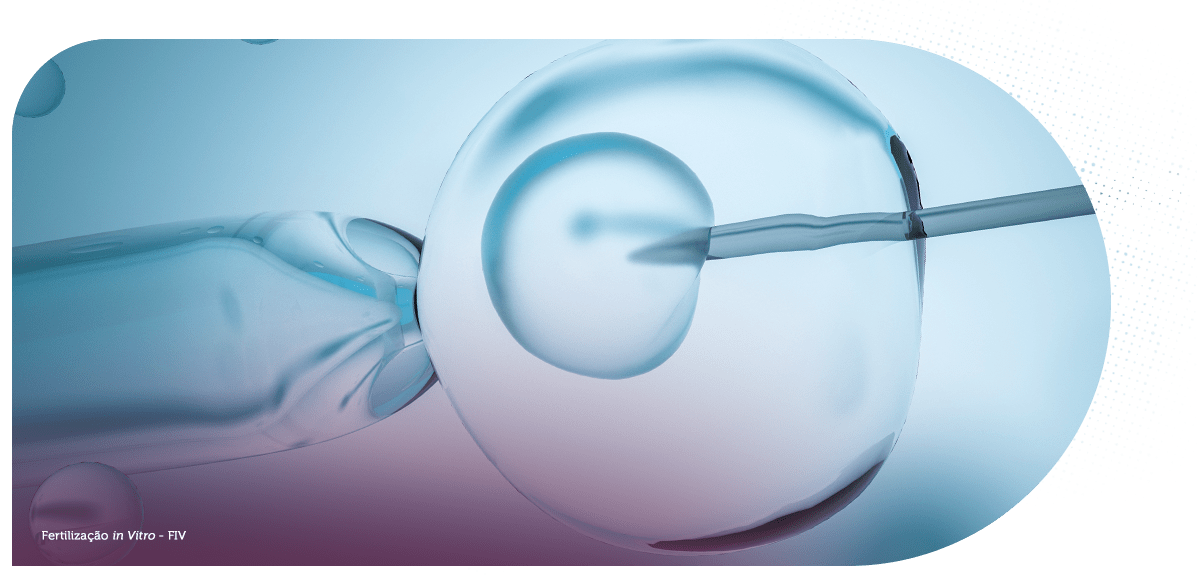
Assim que a fecundação ocorre, seja nas tubas uterinas, seja de forma controlada como acontece na FIV (fertilização in vitro), a célula primordial (zigoto), originada pelo encontro dos gametas, dá início às primeiras etapas do desenvolvimento embrionário.
O desenvolvimento embrionário pode ser dividido em fases, de acordo com a dinâmica de multiplicação celular: clivagens iniciais, estágio de mórula, estágio de blástula, gastrulação e organogênese.
Durante as duas primeiras fases do desenvolvimento embrionário – primeiras clivagens e mórula – a célula primordial se multiplica dando origem a células ainda indiferenciadas, semelhantes à original e contidas pela zona pelúcida do óvulo.
A partir do estágio de blástula, o blastocisto, nome dado ao conjunto total de células do embrião nesta fase, já apresenta as primeiras células diferenciadas, separadas por um espaço preenchido de líquido, chamado antro.
Na gastrulação, acontece a primeira diferenciação celular do embrião, em que as células embrionárias se diferenciam em três tecidos específicos – ectoderme, mesoderme e endoderme –, que durante a organogênese dão origem a todos os órgãos e sistemas do corpo humano.
Aproximadamente na 8ª semana de gestação a organogênese e, consequentemente, o período embrionário, têm fim, e inicia o período de desenvolvimento fetal, em que o bebê cresce e as estruturas formadas no período anterior se desenvolvem, terminando no parto.
Nos tratamentos com fertilização in vitro a fecundação e os primeiros processos do desenvolvimento embrionário podem ser observados durante o período de cultivo embrionário, que antecede a transferência desses embriões para o útero.
Na maior parte dos casos, a transferência é feita durante a fase de mórula ou durante a etapa de blastocisto, dependendo de aspectos específicos, que variam em cada caso, como o número de embriões conseguidos após a fecundação.
A fase de blastocisto merece uma atenção especial, e este texto tem como objetivo mostrar o que é e qual a relevância dessa etapa no contexto dos tratamentos com a FIV.
O que é blastocisto?

Blastocisto é o nome dado ao conjunto de células contido pela zona pelúcida, durante a fase de blástula do desenvolvimento embrionário.
Nessa etapa o principal evento é a separação das células que originam o bebê daquelas que dão origem aos anexos embrionários – placenta, cordão umbilical e líquido amniótico –, localizadas de forma oposta e separadas pelo antro, uma cavidade preenchida por líquido.
Os anexos embrionários são tecidos que dão suporte à gestação, estabelecendo limites e possibilidades, especialmente para o contato entre o bebê e a mulher, nutrição e proteção.
É nessa etapa também que acontece o rompimento da zona pelúcida, num evento chamado hatching, que permite ao embrião fixar-se no endométrio, iniciando a gestação.
Após a definição das células embrionárias propriamente ditas, essas entram em novos processos de diferenciação celular, nas etapas de gastrulação e organogênese, que encerra o período de desenvolvimento embrionário.
Como isso acontece na FIV?
A fertilização in vitro é considerada hoje a técnica de reprodução assistida mais complexa e abrangente entre as disponíveis, por promover a fecundação de forma controlada, em laboratório.
Ainda assim, a metodologia dessa técnica busca adaptar ao máximo os processos envolvidos na fecundação por vias naturais, então podemos dizer que todas as fases de desenvolvimento embrionário mencionadas acontecem da mesma forma, mesmo quando a fertilização é feita em laboratório.
A fecundação na FIV pode ser feita por ICSI (injeção intracitoplasmática de espermatozoide), em que um único espermatozoide é colocado no interior do óvulo por uma agulha especial, em uma placa de vidro, contendo meio nutritivo de cultura adequado, semelhante ao encontrado nas tubas uterinas.
A partir desse momento, o desenvolvimento embrionário pode ser observado por um período de 3 a 6 dias, ou até a fase de blastocisto, num processo que chamamos cultivo embrionário.
Qual a importância do blastocisto para a FIV?
Durante o desenvolvimento embrionário o blastocisto é a primeira formação celular em que é possível observar as células do bebê separadas daquelas que formam os anexos embrionários.
Por isso, quando observados durante o cultivo embrionário da FIV, esse é o momento mais precoce para a identificação de anomalias e doenças genéticas, por ter um acesso mais específico ao material genético do embrião.
É durante a fase de cultivo embrionário que pode ser realizado o PGT (teste genético pré-implantacional), para o rastreio do embrião em busca de doenças ou anomalias genéticas. A prevenção dessas condições é um motivo pelo qual muitos casais buscam auxílio da reprodução assistida.
Além disso, como a etapa de blastocisto é também o momento em que ocorre a implantação embrionária, ou a fixação do embrião no endométrio, é possível também realizar o hatching assistido, em que pequenas incisões são feitas na zona pelúcida do embrião antes da transferência, com o objetivo de facilitar o rompimento dessa camada e a implantação embrionária.
Pelo mesmo motivo, é comum que se escolha realizar a transferência embrionária nessa etapa, que corresponde ao D5 do cultivo, ou 5º dia após a fecundação.
Blastocisto é o único momento para transferência embrionária na FIV?
Em alguns casos, especialmente quando a mulher em tratamento com a FIV tem mais de 35 anos e uma reserva ovariana já sensivelmente menor, é possível que a etapa de fecundação produza menos embriões do que o esperado inicialmente, e de menor qualidade.
Para essas situações pode-se realizar a transferência embrionária antes da etapa de blastocisto, a partir do D3 do cultivo embrionário, quando o embrião atinge o estágio de mórula.
A escolha do melhor momento para realizar a transferência embrionária depende das especificidades de cada caso: das variações no desenvolvimento do embrião, durante a etapa de cultivo, e também da quantidade de embriões conseguidos na fase de fecundação. Por isso, a indicação é feita sempre de forma individualizada.
Quer saber mais sobre transferência de blastocisto? Toque o link e acesse nosso conteúdo.
 Elo Medicina| WhatsApp
Elo Medicina| WhatsApp